Хімічне очищення стічних вод здійснюють переважно трьома способами: нейтралізацією, окисленням і відновленням.
Нейтралізацію проводять для доведення рН січних вод до 6,5—8,5, тобто близького до нейтрального. Отже, нейтралізувати потрібно стічні води з рН < 6,5 (з кислою реакцією середовища) і з рН > 8,5 (з лужною реакцією середовища). Нейтралізацію здійснюють змішуванням кислот стічних вод з лугами додаванням реагентів або фільтруванням через нейтралізуючі матеріали.
Кількість реагенту для нейтралізації стічних вод визначається за формулою
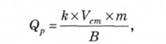
де /г — коефіцієнт запасу реагенту; В — вміст активної речовини у стічній воді; V — об'єм стічних вод, м3; т — витрата реагенту для нейтралізації активних речовин, кг/м3.
Практика свідчить, що найбільшу небезпеку для навколишнього середовища створюють кислі стоки.
При хімічному очищенні застосовують такі способи нейтралізації:
— взаємну нейтралізацію кислих і лужних стічних вод змішуванням;
— нейтралізацію стічних вод реагентами (розчинами кислот, негашеним вапном СаО, гашеним вапном Са(ОН)2, кальцинованою содою N8003, каустичною содою КаОН, розчином аміаку
№ЕЇ4ОН);
— фільтруванням стічних вод через нейтралізуючі матеріали (вапно, вапняк СаС08, доломіт СаС03 • MgC08, магнезит MgCOз, крейда СаС03).
Вибір способу нейтралізації стічних вод залежить від багатьох факторів: виду та концентрації кислот у стічних водах; витрат і режиму подачі відпрацьованих вод на нейтралізацію; наявності реагентів і місцевих умов та ін.
Нейтралізацію розчином вапна й вапняку рекомендують проводити тільки при рівномірній подачі стічних вод, що містять сильні кислоти. Фільтрування через шари вапняку, доломіту й крейди рекомендують для стічних вод, що містять соляну, азотну, сірчану кислоти при рівномірній подачі стічних вод.
В останні роки запропонований спосіб нейтралізації лужних стічних вод димовими газами, які містять С02, 802, N0" та ін. Це дозволяє одночасно очищати й гази, які відходять.
На рис. 5.12, а наведена схема доломітового фільтра-нейтралізатора. У ньому проводиться нейтралізація кислих стічних вод, забруднених соляною, сірчаною або азотною кислотами фільтруванням через шар доломіту. При цьому протікає така хімічна реакція:
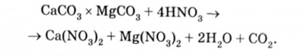
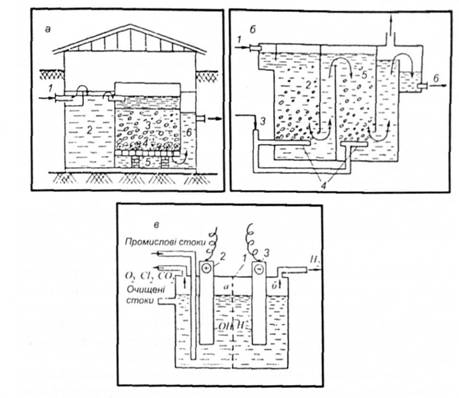
Рис. 5.12. Основні види обладнання для хімічного очищення стічних вод: а — вертикальний доломітовий фільтр-нейтралізатор: 1 — подавання кислих стічних вод; 2 — приймальна камера; З—доломітовий фільтр; 4 — гравій; 5 — дренаж; 6 — випуск нейтралізованих стічних вод; б — контактна камера озонування стічних вод: І — подавання стічних вод; 2,6 — камера озонування; 3 — введення озону; 4 — металокерамічні розпилювальні труби; 6 — вивід стічних вод; в — камера електролітичного знешкодження (анодного окислення): 1 — напівпроникна перегородка; 2 — анод; 3 — катод
Після відпрацювання доломіт вивантажують з фільтра і заміняють свіжим.
Процес нейтралізації постійно контролюється — систематично реєструється стан рН на виході із нейтралізатора. Стабільність і безперебійність роботи фільтра забезпечується надійною автоматикою.
Окислення застосовують для знешкодження виробничих стічних вод, в складі яких є токсичні домішки або сполуки, що недоцільно вилучати. На практиці часто застосовують окислювачі: хлор, хлорне вапно, діоксид хлору, озон, технічний кисень, гіпохлорид кальцію і натрію, кисень та ін.
Залежно від агрегатного стану хлору або хлоровмісних реагентів, що вводять у воду, визначають технологію оброблення стічних вод. Якщо цю воду обробляють газоподібним хлором або озоном, то процес окислення здійснюють в окислювальних колонках або контактних камерах (рис. 5.12, б). Якщо окислювач знаходиться в розчині, то його спочатку подають у змішувач, а потім у контактний резервуар.
При окисленні розчинені отруйні речовини перетворюють у нетоксичні сполуки або в осад відстоюванням або фільтруванням стічних вод.
Хлор, що вводиться у стічну воду, гідролізується з утворенням хлорнуватистої та соляної кислот [1]:
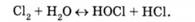
Сильнішим окислювачем, ніж хлор, є озон. Він володіє здатністю руйнувати при нормальній температурі у стічних водах значну кількість органічних сполук і домішок. Озон добувають безпосередньо на очисних спорудах в озонаторах. Він утворюється при електричному розряді в кисневому середовищі між двома електродами, до яких підводиться напруга 5—25 кВ.
У процесі оброблення стічних вод озон, що подаєтеся в контактну камеру (див. рис. 5.12, б) у вигляді суміші, вступає в хімічні реакції з речовинами, що забруднюють воду.
Наведемо приклад характеру реакції окислення сірководню [1]:
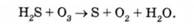
При надлишку озону переважає реакція, в результаті якої утворюється сірчана кислота:
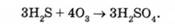
Після цього протікає реакція гідролізу до утворення мало-шкідливих продуктів. Цей спосіб окислення озоном у практиці називають озонуванням.
Озонування дає можливість одночасно знебарвлювати воду, усуває її присмаки, неприємні запахи тощо. Озонуванням можна очищати стічні води від фенолів, нафтопродуктів, поверхнево-активних речовин (ПАР), барвників у ароматичних вуглеводнів, пестицидів на промислових підприємствах.
Озон як окислювач має унікальні властивості. У водному розчині він дисоціює швидше, ніж у повітрі; дуже швидко дисоціює в слабколужних розчинах. У кислотних розчинах озон виявляє високу стійкість. У чистому сухому повітрі озон розкладається дуже повільно. При обробленні води озоном відбуваються розкладання органічних речовин і знешкодження води; бактерії гинуть у декілька тисяч разів швидше, ніж при обробленні хлором, розчинність озону у воді залежить від рН і вмісту у воді розчинених речовин. Невеликий вміст кислот і нейтральних солей збільшує розчинність озону.
Дія озону в процесах окислення може відбуватися трьома способами: безпосереднє окислення за участі одного атома кисню; приєднання цілої молекули озону до речовини, що окислюється з утворенням озонідів; окислювальна дія кисню за допомогою каталізатора — озону.
Озон подають у стічну воду у вигляді озоно-кисневої суміші. Концентрація озону в суміші — близько 3 %. Для підсилення процесу окислення суміш диспергують у стічній воді на дрібненькі бульбашки газу (див. рис. 5.12, б). Озонування — це процес абсорбції, який супроводжується хімічною реакцією в рідкій фазі. Витрата озону, необхідного для окислення забруднень, може визначатись за рівнянням масообміну:
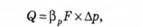
де ф — витрата озону, що переходить із газової фази в рідку, кг/с; Рр — коефіцієнт масовіддачі в рідкій фазі при протіканні в ній хімічної реакції, м/с; .Р — поверхня контакту фаз, м2; Ар — рушійна сила процесу, кг/м8.
Озон отримують із кисню повітря під дією електричного розряду в генераторах.
Метод відновлення застосовують для очищення стічних вод у випадках наявності легковідновлюваних речовин (ртуть, миш'як, хром). На промислових підприємствах цей метод застосовують рідко.
Разом з озонуванням і хлоруванням виробничих стічних вод застосовують електрохімічне окислення, що ґрунтується на електролізі виробничих стічних вод (див. рис. 5.12, в). Основу електролізу виробничих стічних вод становлять два процеси: анодне окислення і катодне відновлення.
На аноді, виготовленому з платини або графіту, виділяються кисень і галогени, а також окисляються деякі органічні сполуки, наявні у стічних водах. На катоді виділяється водень і відновлюються деякі органічні сполуки. Внаслідок високої вартості електрохімічне окислення для очищення стічних вод має обмежене застосування.
5.7. Біологічне очищення стічних вод
5.8. Очищення стічних вод машинобудівних підприємств
5.9. Очищення стічних вод від формальдегіду і фенолу на деревообробних підприємствах
5.10. Очищення стічних вод при виробництві деревоволокнистих плит
5.11. Очищення стічних вод целюлозно-паперових підприємств
5.12. Утилізація та усунення осаду виробничих стічних вод
5.13. Перспективні методи очищення атмосфери та виробничих стічних вод від шкідливих речовин
5.14. Захист ґрунтів і земельних ресурсів від шкідливих викидів
Розділ 6. ПЕРЕРОБЛЕННЯ ТА ЗНЕШКОДЖЕННЯ ПРОМИСЛОВИХ ВІДХОДІВ ДЛЯ ПІДВИЩЕННЯ ЕКОЛОГІЧНОЇ БЕЗПЕКИ ДОВКІЛЛЯ