Горінням називають екзотермічну реакцію, яка відбувається в умовах її прогресивного самоприскорення. Горіння може відбуватися як в результаті хімічної реакції сполучення, так і розпаду речовин не тільки при сполученні з киснем повітря, але і з речовинами, які вміщують його в собі (наприклад, вапно). Горіння багатьох речовин може відбуватися в середовищі хлору, парів брому, сірки.
Горіння поділяють на кілька видів: спалахування, займання, запалення, самозаймання, самозапалення.
Температура спалаху - це найменша температура концентрованої речовини, за якої в умовах спеціальних випробувань над її поверхнею утворюється пара, що здатна спалахувати в повітрі від джерела запалювання; стійке горіння при цьому не виникає.
Спалахування - це швидке згоряння горючої речовини, яке не супроводжується утворенням стисненого газу.
Нижче температури спалахування рідина не становить пожежної небезпеки в разі короткочасної дії полум'я, іскри або розжареного тіла. Якщо рідина нагріта до температури спалахування і вище, то навіть короткочасна дія на ЇЇ пару полум'я або іскри неминуче викличе її займання, і за певних умов може виникнути пожежа. Беручи це до уваги, температуру спалаху взято за основу класифікації рідин за ступенем пожежної безпеки. Рідини, що здатні горіти, поділяються на легкозаймисті (ЛЗР) і горючі (ГР)*.
Вогненебезпечні речовини, які найчастіше зустрічаються в авіації, мають такі температури спалаху (в градусах Цельсія):

*До легкозаймистих рідин належать горючі рідини з температурою спалаху, яка не перевищує 61°С під час визначення в закритому тиглі, або 66°С - при визначенні у відкритому тиглі. Рідини з температурою спалаху вище вказаної відносяться до горючих.
Залежно від температури спалаху необхідно вибирати безпечні методи транспортування, збереження і застосування рідини для різних цілей. При температурі спалаху стійке горіння не виникає, а згорає тільки утворена над рідиною суміш парів з повітрям. Якщо температура рідини трохи вища за температуру спалаху, швидкість випаровування її з відкритої поверхні підвищується, і в момент спалаху суміші рідина здатна виділяти безперервно пару в достатній кількості для стійкого горіння. Таку температуру називають температурою запалення. Це - найменша температура речовини, за якої в умовах спеціальних випробувань речовина виділяє горючу пару і гази з такою швидкістю, що при дії на них джерела енергії відбувається їхнє запалювання.
Запалення - це займання, яке супроводжується появою полум'я.
У легкозаймистих рідин температура запалення вища температури спалаху на 1-5°С, до того ж, чим нижча температура спалаху рідини, тим менша ця різниця. Так, у бензолу, ацетону, які мають температуру спалаху нижчу від нуля, ця різниця дорівнює 1°С, у горючих рідин - ця різниця доходить до 30°С і вище.
Самозаймання — це різке збільшення швидкості екзотермічних об'ємних реакцій, яке призводить до різкого підвищення температури і до виникнення горіння речовин при відсутності джерела запалювання.
Теплова теорія самозаймання була вперше розроблена С.Н. Семеновим і в подальшому детальніше розвинута Д. А. Франк-Каменецьким і О. М. Тодесом.
Основні положення цієї теорії можна розглянути на прикладі самозаймання суміші горючих парів або газів з повітрям. При низькій температурі Т0 (наприклад, плюс 20°С) реакція між гасом і киснем повітря в суміші практично не протікає, тому що відсутні активні молекули кисню. Для того щоб вони з'явилися і почалась реакція окислення, суміш треба нагріти до більш високої температури Т1. Для цього вміщують посуд із сумішшю в середовище, яке має температуру Т1 (рис 15,1, а). Через деякий час посуд і суміш в ньому нагріються до температури Т1 і в суміші виникне процес окислення з виділенням тепла. Виділене тепло q1 передається горючій суміші, яка нагріється до температури Т1. Однак, як тільки температура суміші перевищить температуру стінок посуду і зовнішнього середовища, почнеться тепловідвідвід суміші до стінок посуду і далі - до зовнішнього середовища. Кількість відведеного тепла позначимо через q2.
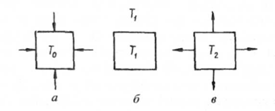
Рис. 15.1. Схема, що пояснює процес самозаймання спалимої суміші:
а- нагрів суміші за рахунок підведеної до неї теплової енергії; б - теплова рівновага; в - самонагрівання суміші та вивід від неї тепла в навколишнє середовище
Подальше нагрівання суміші буде залежати від співвідношення швидкостей тепловиділення та тепловідводу. Якщо q1 > q2 то суміш, окислюючись, буде нагріватись, а якщо q1 = q2, то суміш буде окислюватись за будь-якої постійної температури, при якій виникло це співвідношення. Припустимо, що швидкість виділення тепла за рахунок окислення суміші перевищує швидкість тепловідводу. Однак цього ще недостатньо, щоб суміш продовжувала нагріватися і подалі, тому що з підвищенням температури горючої суміші швидкість виділення тепла і тепловідводу збільшується не однаково. І якщо зі збільшенням температури суміші швидкість тепловідводу буде зростати швидше, ніж тепловиділення, то при деякій температурі суміші вони стануть рівними (91=92) і надалі нагрів призупиниться. Це зазвичай відбувається при малій швидкості окислення горючої речовини або при великому тепловідводі.
Наприклад, сталеві стружки та ошурки також окислюються, тому відбувається виділення тепла, але у зв'язку з малою швидкістю окислення це не завжди призводить до горіння. У плівці масляної фарби на пофарбованій поверхні відбувається процес окислення, але через дуже велику поверхню посилення тепловідводу нагрівання її не спостерігається.
Отже, суміш, нагріта до температури Т2 за рахунок реакції , окислення, буде поступово остигати до температури Т1 (як тільки концентрація реагуючих речовин в суміші почне зменшуватися). Із цього виходить, що процес окислення горючої суміші, нагрітої до температури Т, не може перейти в горіння через малу швидкість реакції.
Збільшимо швидкість окислення суміші, нагріваючи її до температури Т3. Швидкість тепловідводу при цьому залишиться постійною, тому що поверхня посудини не змінилася. Це може призвести до того, що при температурі горючої суміші Ту швидкість виділення тепла постійно буде перевищувати швидкість тепловідводу і суміш дістане можливість самонагріватися до високої температури. Коли температура суміші досягне температури горіння, з'явиться полум'я і виникне горіння. Отже, обов'язковою умовою протікання процесу самозаймання є перевищення швидкості виділення тепла в суміші над швидкістю тепловідводу.
Отже, тепловим самозайманням називають процес виникнення горіння, який відбувається внаслідок самонагрівання речовин, нагрітих до стану, в процесі якого швидкість виділення тепла за рахунок реакції окислення перевищує швидкість тепловідводу. За температуру самозаймання зазвичай беруть температуру стінок посудини, за якої в даних умовах відбувається самозаймання.
Процес теплового самозаймання можна розглядати залежно від часу (рис. 15.2).
Помістимо горючу речовину в повітря, нагріте нижче температури окислення. Температура речовини в цьому випадку буде повільно підвищуватися (крива 1) і через певний час буде дорівнювати температурі повітря Т0. Тому що Т0 нижча від температури окислення, горюча речовина буде поводитися так, як негорюча. Якщо повітря нагріти до температури Т1, яка буде вищою від температури окислення цієї речовини, відбудеться розігрів горючої речовини (крива 2) до температури, більшої за Т1 але потім температура почне знижуватися.

Рис. 15.2. Графік зміни температури спалимих речовин при нагріванні
Розігріємо повітря до температури Тs > Т1. Природно, що швидкість реакції окислення в цьому випадку буде набагато вищою, ніж в попередньому, і температура речовини підніметься вище температури повітря Ts, досягаючи значення Tв, після чого відбудеться швидке зростання температури речовини до температури горіння. Розглянутий процес самозаймання на прикладі газової суміші характерний не тільки для горючих парів та газів. Він поширюється також на тверді речовини.
Температура самозаймання не є постійною величиною для однієї й тієї ж горючої речовини. Вона залежить від швидкостей тепловиділення і тепловідводу, які в свою чергу залежать від об'єму і форми горючої речовини, складу її в одиниці об'єму, тиску та інших факторів. Границі температури самозаймання (у градусах Цельсія) деяких легкозаймистих і горючих речовин такі:

Крім теплового (із зовнішнім нагрівом), самозаймання ще буває мікробіологічним і хімічним.
Мікробіологічне самозаймання виникає внаслідок самонагрівання у масі речовини під дією мікроорганізмів. Це явище спостерігається під час зберігання зерна, сіна, торфу, вугілля тощо.
Хімічне самозаймання відбувається внаслідок хімічної взаємодії речовин при дії на них повітря і води (рослинна олія і тваринні жири, мастила) при наявності великої поверхні окислення і малої тепловіддачі у навколишнє середовище.
Температура самозаймання у деяких горючих речовин може перевищувати 500°С, а у інших - бути нижчою від 16°С. Усі горючі речовини за температурою самозаймання умовно можна розподілити на дві групи: речовини, які мають температуру самозаймання вищу від звичайної (16-25°С) і нижчу. Речовини першої групи здатні самозайматися тільки при нагріванні їх до тієї чи іншої температури, речовини другої групи - самозаймаються без додаткового нагрівання, оскільки навколишнє середовище вже нагріло їх до температури запалення. Горючі речовини являють собою підвищену пожежну небезпеку, оскільки не виключена можливість їхнього запалювання за певних умов. Наприклад, алюміній у вигляді пудри в результаті окислення здатний на самонагрівання до виникнення горіння. Самонагрівання може початися за звичайної температури навколишнього середовища і навіть нижчої, а завершитися горінням. Якщо тонку тканину, просочену оліфою, скласти щільно, то тепло, яке утвориться при окисленні, не встигне розсіятися в повітрі й запалить тканину. Однак, якщо ту ж тканину розкласти, не згортаючи, то самозаймання не відбудеться, оскільки тепло, яке виділяється під час швидко протікаючого процесу окислення, буде розсіюватися у навколишньому середовищі зі швидкістю, яка перевищує швидкість його утворення.
Отже, дуже важливо знати речовини, які належать до другої групи, оскільки це дозволяє поставити до умов їхнього зберігання і транспортування особливі вимоги, які унеможливлюють виникнення пожежі.
Наприклад, як відомо, існують мінеральні, рослинні й тваринні мастила. Мінеральні мастила окислюються на повітрі тільки при високій температурі, а тому не самозаймаються. Відомі випадки самозаймання ганчір'я, змоченого мінеральними авіаційними мастилами, які виникали внаслідок потрапляння в нього домішок рослинних мастил. Жири і мастила, які вміщують органічні сполуки, здатні до самозаймання.
Про здатність до самозаймання можна зробити висновок за Йодним числом - кількістю грамів йоду, яка вступає в сполуку з 100 г мастила. Чим більше в мастилі сполук, тим воно більше приєднує йоду і, отже, має більшу здатність до самозаймання.
Оліфа з добавленими для прискорення висихання сикативами, нанесена на волокнисті матеріали, здатна до самозаймання. Напівнатуральні й штучні оліфи малоспроможні або неспроможні самозайматися. Мастила, жири або оліфи, які знаходяться в будь-якій закритій тарі, самозайматися не можуть, оскільки поверхня дотику їх з повітрям дуже мала. Здатність мастил і жирів до самозаймання значно зростає, коли поверхня окислення значно більша від поверхні тепловіддачі. Такі умови створюються, коли промаслені матеріали складені в купи, штабелі, пакети і прилягають близько один до одного. Самозаймання мастил і жирів залежить також від щільності упаковування промасленого матеріалу. Здатність його до самозаймання збільшується в разі ущільнення до певної межі, після якої починає зменшуватись.
Важливу роль у процесі самозаймання відіграє і температура навколишнього середовища. Чим вища температура повітря, тим менший об'єм промасленого матеріалу здатного до самозаймання, при цьому і мастил потрібно менше. Імовірність виникнення пожежі в цьому випадку зростає в декілька разів.
Найменша температура, за : якої спостерігається самозаймання мастил і жирів, дорівнює 10-15°С. Бавовняні відходи, просочені рослинними оліями (обтиральні кінці тканини), можуть самозайматися залежно від умов у різні строки (від кількох годин до кількох діб).
Період індукції (період запізнення самозаймання) речовин, які здатні самозайматися, у газів і рідин, що окислюються в газоподібному середовищі, дуже короткий. Майже такий же період і у твердих речовин, які знаходяться у стані аерозолів.
Період індукції твердих речовин у вигляді грудок різного розміру може бути тривалим, оскільки поверхня окислення у даному випадку мала. Невелика також і швидкість дифузії повітря у поверхню окислення.
Самозапаленням називається самозаймання, що супроводжується появою полум'я. Горіння може супроводжуватися пожежею та вибухом.
За горючістю речовини і матеріали поділяються натри групи: - неспалимими є матеріали і конструкції, які під дією вогню або високої температури не займаються, не тліють і не обвуглюються (наприклад, окислювачі або речовини, які виділяють горючі продукти під час взаємодії з водою, киснем повітря або один з одним);
- важкоспалимими є матеріали і конструкції, які під дією вогню або високої температури займаються, тліють або обвуглюються і продовжують горіти і обвуглюватися при наявності джерела запалювання, а після його видалення ці процеси припиняються.
До них належать штучні матеріали, які, крім негорючих мінеральних речовин, мають більше 80 % по масі органічних заповнювачів; конструкції, виготовлені із важкоспалимих матеріалів, а також із спалимих, захищених від вогню і високих температур неспалимими матеріалами (дерево, покрите азбестом і покрівельним залізом);
— спалимими вважають такі матеріали і конструкції, які під дією вогню або високої температури горять, тліють або обвуглюються і горять після видалення джерела запалювача. До них відносять всі органічні матеріали, не захищені від вогню або високих температур.
Більшість спалимих речовин незалежно від їхнього початкового агрегатного стану (тверді, рідкі, газоподібні) під час нагрівання переходять у газоподібні продукти і утворюють з повітрям спалимі суміші. Підготовленість до займання визначається складом (концентрацією) в них пари, пилу або газоподібних продуктів. Існують мінімальні й максимальні концентрації спалимих речовин у повітрі, нижче і вище яких займання неможливе.
Ці концентрації відповідно називають нижньою і верхньою концентраційними границями займистості.
Спалимі гази і тверді подрібнені речовини (пил) можуть утворювати спалимі суміші за будь-якої температури. Тверді речовини, а також рідини утворюють спалимі суміші тільки за певних температур. Якщо спалима суміш підготовлена з додержанням вищевказаних умов, то можна вважати, що вона підготовлена до займання, яке може виникнути в разі появи джерела запалювання.
Температурними границями поширення полум'я (займання) називають такі температури речовини, за яких її насичена пара створює в окислювальному середовищі концентрації, що дорівнюють відповідно нижній (нижня температурна границя) І верхній (верхня температурна границя) концентраційним границям поширення полум'я.
Значення температурних границь поширення полум'я застосовують: під час розробки заходів із забезпечення пожежо- і вибухонебезпеки об'єкта; для розрахунку пожежо- і вибухонебезпечних температурних режимів роботи технологічного обладнання; оцінки аварійних ситуацій, пов'язаних з розливом спалимих рідин; розрахунку концентраційних границь поширення полум'я. Значення температурних границь необхідно включати у стандарти або в технічні умови на спалимі речовини. Можливість виникнення горіння в основному характеризується температурами спалаху, запалювання, самозапалювання і самозаймання.
15.4. Класифікація причин можливого виникнення пожежі та вибуху
Глава 16. ПРОТИПОЖЕЖНИЙ ЗАХИСТ
16.1. Загальні положення. Організація пожежної охорони
16.2. Вогнестійкість будівель і споруд. Класифікація виробництв за вибухо- і пожежонебезпекою
16.3. Протипожежні перепони в будівлях і спорудах, шляхи евакуації, вимоги до генерального плану
16.4. Вимоги пожежної та вибухової безпеки при виконанні основних технологічних процесів
16.5. Пожежна і вибухова безпека під час улаштування і експлуатації електрообладнання та електроосвітлення
16.6. Пожежна безпека в аеропортах та на повітряних суднах
Глава 17. ЗАСОБИ ГАСІННЯ ПОЖЕЖ