Білки, або протеїни, - це високомолекулярні біополімери, мономерами яких є залишки амінокислот. Назва "білки" пов' язана зі здатністю багатьох білків біліти при нагріванні. Висока температура призводить до зміни їхньої конформації (від лат. konphormatio - розміщення) (просторової структури). А назва "протеїни" походить від грецького слова "перші" і відображає їхню роль у живих організмах. Білки входять до складу всіх живих систем, на них припадає від 50 до 80% сухої маси клітини.
У самій назві амінокислот відображено наявність у їхньому складі: аміногрупи (--NH2), якій притаманні лужні властивості, та карбоксильної групи (-СООН) з кислотними властивостями. Таким чином, амінокислоти - це амфотерні (від грецьк. amphoteros - обидва) сполуки, які реагують не лише з лугами, а й з кислотами.
Аміногрупа та карбоксильна група зв' язані з одним і тим самим атомом карбону. Групи атомів, за якими амінокислоти розрізняються між собою, називають радикалами, або R -групами.
Загальна формула амінокислоти:
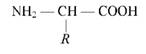
Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків 20 амінокислот. Ці 20 амінокислот називають основними.
Реакція полімеризації амінокислот пов'язана із взаємодією між карбоксильною групою (- СООН) однієї амінокислоти і аміногрупою (--NH2) іншої. У ході реакції виділяється молекула води і утворюється пептид (від грецьк. peptos - зварений). Тому ковалентний зв'язок між залишками амінокислот називається пептидным.
Схема пептидного зв'язку: - СО- NN -
До вільних карбоксильної та аміногрупи можуть приєднуватися інші амінокислоти, подовжуючи ланцюг, який має назву поліпептидного:
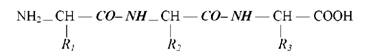
Поліпептидні ланцюжки мають певну конформацію. При зміні її білок втрачає здатність взаємодіяти з іншими молекулами. Конформація білка залежить від послідовності амінокислотних залишків та від середовища. Поліпептидний ланцюг білків на відміну від полісахаридів не має розгалуженої структури.
Властивості білка визначаються послідовністю амінокислотних залишків, що входять до складу його молекули.
Первинна структура білка - це сполучені пептидними зв'язками залишки амінокислот, що мають вигляд лінійного ланцюга. Отже, первинна структура білка визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю. Однак молекула білка у вигляді лінійного ланцюга нездатна виконувати специфічні функції. Для цього вона має набути складнішої просторової структури.
Вторинна структура білка характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль. Отже, вторинна структура білка - закручений у спіраль поліпептидний ланцюг. Радикали амінокислот при цьому залишаються ззовні спіралі. У підтриманні вторинної структури важлива роль належить водневим зв 'язкам, які виникають між атомами гідрогену NH-групи (пептид-ної) одного витка спіралі та оксигену СО-групи іншого. Водневі зв'язки значно слабші за ковалентні, але завдяки тому, що спіраль "прошита" численними водневими зв'язками, її структура дуже міцна. Таким чином, вторинна структура білка стабілізується водневими зв'язками між пептидними групами, розташованими на сусідніх витках спіралі.
Третинна структура білка зумовлена здатністю поліпептидної спіралі закручуватись певним чином у грудку, або глобулу (від лат. globulus - кулька). Скручування відбувається внаслідок взаємодії амінокислотних радикалів на віддалених ділянках ланцюга. Третинна структура білка підтримується кількома типами зв'язків: водневими, гідрофобними, ковалентними дисульфідними (-S-S-). Стабільність третинної структури залежить від внутрішньоклітинного середовища, зокрема від рН і температур. Значні коливання температури або зміни хімічного складу клітини порушують третинну структуру білка і негайно впливають на його функціонування. Надмірне нагрівання або вплив сильнодіючих хімічних речовин призводить до денатурації (від лат. de - рух униз, втрата, natura - природні властивості) - незворотного руйнування певної структури білка. При денатурації первинна структура білка лишається незмінною, а порушуються вищі її рівні.
Чимало білків складаються з кількох поліпептидних ланцюгів, які утримуються разом завдяки гідрофобним взаємодіям, а також водневим та іонним зв'язкам. Поєднання кількох поліпептидних ланцюгів називається четвертинною структурою білка.
За складністю будови та функціями білки поділяють на окремі класи:
o прості - протеїни (від грецьк. protos - перший), що складаються тільки з амінокислот;
o складні - протеїди (від грецьк. protos - перший, eidos - вигляд) - такі білки, що містять, крім амінокислотного ланцюга, ще й небілковий компонент.
Функції білків:
o структурна, або будівельна, - білки входять до складу всіх органів і тканин, є структурними компонентами клітинних мембран;
o регуляторна - білкові гормони регулюють процеси життєдіяльності організмів;
o каталітична, або ферментативна, - особлива група білків - ферментів, які виконують функцію біологічних каталізаторів (біокаталізу), тобто здатні регулювати (прискорювати або гальмувати) хімічні реакції; основу ферментів складають білки, до яких може приєднуватися небілкова частина (вітаміни, метали тощо). Ферменти каталізують лише певні реакції. Кожна молекула ферменту здатна здійснювати від декількох тисяч до декількох мільйонів операцій за хвилину. Для ферментів характерна закономірна локалізація, оскільки процес розщеплення або синтезу будь-якої речовини у клітині поділений на ряд хімічних операцій, які закономірно ідуть одна за одною. Кожну з цих операцій каталізує свій фермент. Дія ферментів залежить від температури і pH середовища;
o енергетична- при повному окисненні 1 г білка виділяється 17,2 кДж енергії;
o сигнальна - окремі складні білки клітинних мембран, змінюючи свою структуру, передають сигнали із зовнішнього середовища на інші ділянки мембрани або всередину клітини.
Питання для самоперевірки
ЛЕКЦІЯ 4. Клітинний рівень організації живої матерії
1. Цитологія - наука про будову та функції клітин. Історія вивчення клітин
2. Методи цитологічних досліджень
3. Загальна будова та життєдіяльність клітин еукаріотів
4. Особливості будови та життєдіяльності клітини рослин
Питання для самоперевірки
ЛЕКЦІЯ 5. Тканинний рівень організації живої матерії. Рослинні тканини
1. Поняття про тканини